在化学分子中,像左手和右手的关系一样:不能完全相互叠合,但互为镜象;像这样与自身镜象不能完全叠合的分子称为手性分子。

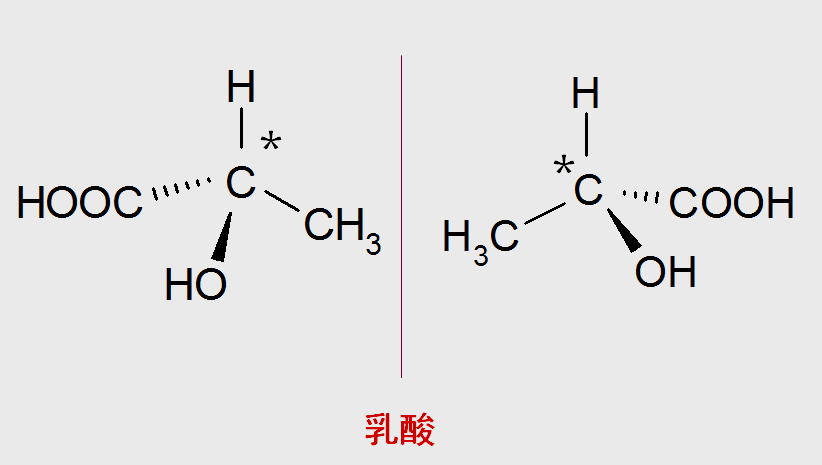
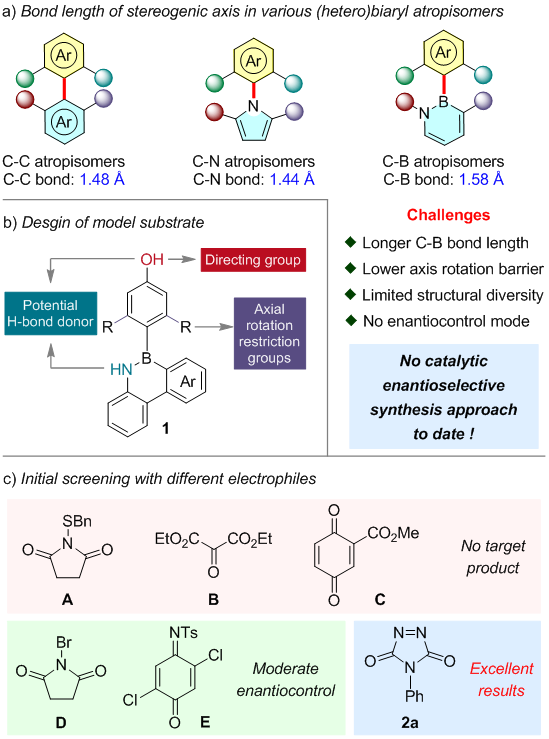
轴手性分子骨架作为手性分子的一类,其结构单元广泛存在于天然产物中,并且在不对称催化、材料科学和药物化学等领域也应用广泛。近年来,轴手性化学领域获得了迅速发展,但是碳-杂原子轴手性领域进展缓慢。种类多样性的限制,制约了其在不对称催化、医药以及材料化学等领域的进一步应用开发。
氮杂硼芳环类化合物具有特殊的电子和光物理特性,使其在有机半导体等新材料领域具有潜在应用。此外,该类化合物对于设计具有生物学功能的新型候选药物及其类似物具有重要的意义。尽管该类化合物的构建吸引了许多化学家的注意,但是该领域的进展仍十分缓慢,直到2016年才出现C-B轴手性化合物的首例报道。一方面该类化合物的骨架结构与合成方法比较局限,导致其结构的多样性受到限制;另一方面C-B键的分子间距为1.581 Å,导致其更难实现阻转异构。
近日,深圳大学化学与环境工程学院张俊民副教授课题组与南方科技大学谭斌教授课题组合作在《J. Am. Chem. Soc.》(影响因子15.419,中科院JCR一区,TOP期刊)上发表了题目为《Chiral Phosphoric Acid-Catalyzed Remote Control of Axial Chirality at Boron−Carbon Bond》的研究论文。该论文第一作者为我校杨君贤博士,通讯作者为张俊民副教授和南方科技大学谭斌教授、向少华研究助理教授,深圳大学为第一完成单位。
该项研究以B-aryl-1,2-azaborines与diazodicarboxamides为反应底物,手性磷酸作为催化剂,通过远程的去对称化策略,成功实现了手性C-B轴手性化合物的不对称构建。该工作重点聚焦:1)如何实现具有更长分子间距的C-B轴手性的不对称构建;2)探究催化剂与底物作用机理以及反应高效的原因。
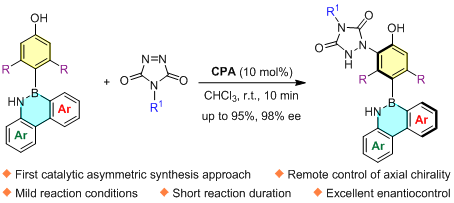
该反应在温和的条件下,仅需要最长15分钟的时间,就可以以最高95%的产率和98的ee值获得目标产物。对于B-aryl-1,2-azaborines底物与diazodicarboxamides底物不同的取代基均具有非常好的兼容性,而且也可以实现C-B与C-C双轴手性的不对称控制。同时该反应可以进行克级规模的合成,并且仍能保持优异的产率和对映选择性。通过对反应机理的研究,初步表明单个磷酸与两种底物之间形成的氢键网络,是该反应成功的关键。值得注意的是,消旋化实验表明产物的轴手性是非常稳定的(120℃下反应24h,产物的ee值无任何损失)。该研究有利于丰富轴手性化合物库,推动轴手性化学的发展,而且有助于推动这类骨架结构在催化、医药、材料化学领域的发展和应用。
该研究得到了国家自然科学基金委、广东省教育厅、广东省催化重点实验室、深圳市科技创新委员会等项目支持。
全文链接见:https://pubs.acs.org/doi/10.1021/jacs.1c05079
论文作者简介:
张俊民,深圳大学化学与环境工程学院副教授,兼任深圳大学分子科学国际合作联合研究中心副主任(执行主任),广东省高等学校优秀青年教师,深圳市高层次专业人才。主要从事有机与药物合成(绿色可持续的催化合成、不对称催化与手性药物合成)方向的研究工作。目前完成和主持国家自然科学基金项目2项、广东省教育厅科研项目3项、深圳市科研项目5项。至今以第一作者/通讯作者在J. Am. Chem. Soc.(2篇)、Angew. Chem. Int. Ed.、Adv.Mater.、Chem. Sci.、Green. Chem.(2篇)、ChemSusChem、Org. Chem. Front.、Org. Lett.(2篇)等中科院一区期刊发表SCI论文近20篇。
杨君贤,2019年6月兰州大学博士毕业,2019年9月入职深圳大学化学与环境工程学院博士后。主持中国博士后科学基金面上项目一项,目前以第一作者在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Org.Lett.等杂志发表论文4篇。





