高等真核生物中,有一类长度约为19-30个碱基的小RNA,在调控基因表达、抗病毒以及维持基因组稳定性等一系列重要生理过程中起关键作用。Dicer核酸内切酶是小RNA生物合成的核心分子,Dicer在小RNA的产生过程中,起到“分子尺”的功能,从前体RNA的一端测量特定的长度并切割产生特定的小RNA。过去二十多年,研究者们针对Dicer核酸酶开展了大量的系统研究,然而这个过程中Dicer作为一个整体是如何测量RNA的长度、如何特异性识别RNA的末端等核心问题仍没有得到完整的分子机制解析。
近日,深圳大学医学部李思思副教授课题组和南方科技大学生命科学学院杜嘉木教授课题组以及美国加州大学洛杉矶分校Steven Jacobsen教授课题组共同合作,对Dicer开展了深入的结构功能研究,以“Mechanism of siRNA production by a plant Dicer-RNA complex in dicing competent conformation”为题在国际顶尖学术杂志Science上发表了最新的学术进展,阐释了Dicer家族酶的分子作用机制。深圳大学为第四完成单位,南方科技大学、加利福尼亚大学洛杉矶分校、清华大学为合作单位。
利用南方科技大学的冷冻电镜平台,研究人员解析了一个植物来源的Dicer蛋白DCL3与其前体小RNA的复合物结构(图1),该结构分辨率高达3.1埃,可以直接观测到此前所一直没有观测到的末端识别和定点切割机制。在RNA的末端,DCL3利用一个正电富集的结合口袋特异性识别前体小RNA前导链的5‘磷酸,从而将RNA的第一个碱基对打开,更进一步对前导链的第一个碱基A产生特异性识别;与此同时,DCL3利用一簇芳香族氨基酸对前体小RNA的互补链的1 nt 3’-overhang末端进行识别,防止3‘末端的延伸。以这些相互作用为起点,在另一侧,DCL3的两个RNaseIII结构域对前体小RNA的两条链分别进行切割。DCL3利用自身RNA末端结合口袋至RNaseIII结构域之间的距离来测量前体小RNA,达到特定的长度后进行切割。
生化上,Dicer家族酶同时具备5’磷酸依赖的测量和3‘-overhang依赖的测量两类机制。研究人员继续对DCL3针对不同长度的3’-overhang的前体小RNA的酶活进行了测定,发现随着overhang长度的延伸,活性只是降低但并没有完全丧失。为解析其识别机制,研究人员继续解析了DCL3和更长的2 nt 3‘-overhang前体小RNA的复合物结构,发现更长的overhang可以通过loop-out机制反转出RNA,在末端又折叠回来形成类似的识别。解释了其具备活性又有所降低的机制。后续的体内、体外突变体实验进一步验证了结构的观测。
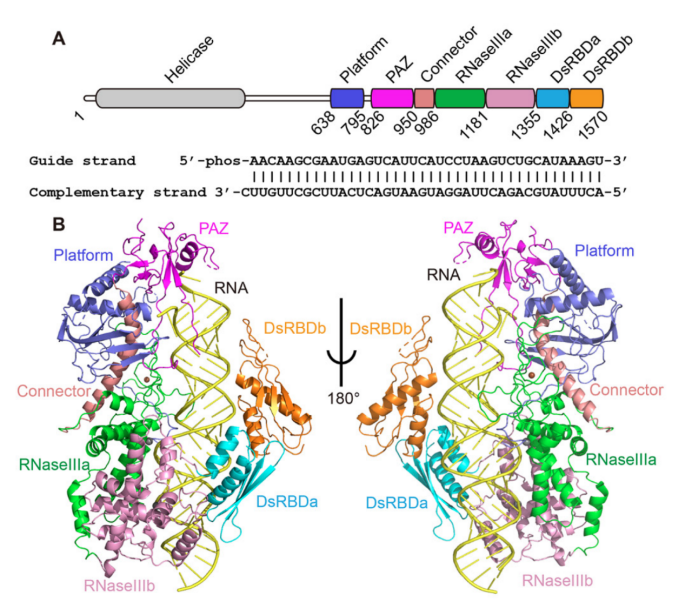
图1 拟南芥DCL3结合RNA底物的复合物结构
项目支持:
广东省创新创业团队项目,2016ZT06S172,系统表观遗传学在农作物改良中的应用,2017/06/01-2022/05/31,在研,第一核心成员
论文链接:https://doi.org/10.1126/science.abl4546





