近日,深圳大学化学与环境工程学院博士王奔、中国科学院深圳先进院研究员徐天添、香港中文大学教授张立等,在机器人仿生设计和运动控制领域取得重要突破。研发出基于患者自体血液、具备仿根结线虫结构与多模态仿生运动能力的磁驱血凝胶纤维机器人,实现对颅内深部区域的精准、微创药物递送(图1)。成果于2025年5月1日发表在Nature Biomedical Engineering上。王奔为第一作者与共同通讯作者。该工作历时超3年,化学与环境工程学院2020级本科生叶芷澄(现为香港中文大学博士生)、何家俊(现为深圳大学硕士生)等全程参与了该工作。

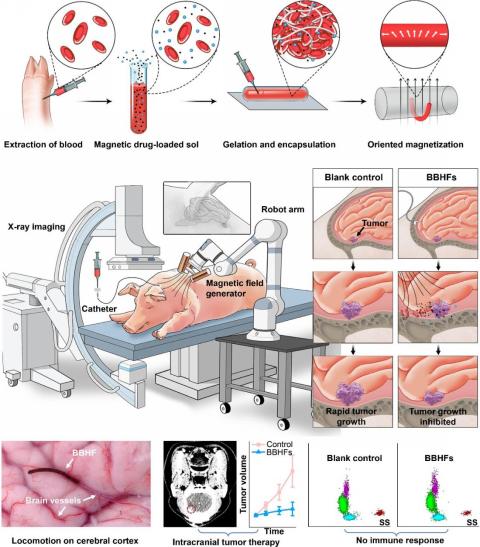
图1.源自患者自体血液的凝胶纤维机器人用于颅内深部操控与递送
位于脑深部或毗邻关键功能区的颅内肿瘤,其复杂的解剖位置和高度敏感的周围组织环境,使其在临床治疗中长期面临巨大挑战。传统开颅手术需穿越重要神经通路和血管网络,操作风险极高,极易造成不可逆的神经功能损伤和术后并发症。放射治疗虽然具备一定的非侵入性,但难以避免对健康脑组织的累积辐射损伤和脑组织坏死。化疗又受限于血脑屏障,药物难以有效到达病灶。因此,如何在不损伤正常脑组织的前提下,实现对深部及功能区邻近肿瘤的高效、精准、无创治疗,已成为神经肿瘤领域亟需攻克的难题。
针对上述问题,团队开发了一种基于患者自身血液的磁驱动生物混合血液水凝胶纤维机器人。该机器人能逃避免疫系统识别和排斥,在可编程磁场驱动下实现摆动、爬行、滚动等多种仿生运动,并可通过X射线实时追踪,实现颅内肿瘤的精准药物靶向治疗。
团队突破传统血管递送路径,利用脑脊液这一“天然航道”,设计出适应脑脊液环境、可控多模态运动的磁驱动血液凝胶纤维机器人。其核心创新体现在三方面:材料上,采用患者自体血液中的纤维蛋白,通过仿生凝胶化技术,打造与脑组织力学性能匹配的柔性载体,实现免疫“隐身”;运动控制上,借鉴线虫运动机制,嵌入磁性颗粒的机器人可在外磁场下灵活运动,并结合X射线成像实现复杂脑区精确导航;药物释放环节,利用磁致机械断裂机制,机器人到达肿瘤后通过高强度交变磁场快速碎化,集中释放药物,形成局部高浓度。
该研究将生物材料、软体机器人、医学影像等多学科前沿技术深度融合,充分发挥深港两地在机器人设计、仿生运动和临床转化等领域的协同创新优势,为个性化、无创颅内治疗开辟了全新路径。
论文信息:Ben Wang†*, Jie Shen†, Chenyang Huang†, Zhicheng Ye, Jiajun He, Xinyu Wu, Zhiguang Guo, Li Zhang*, Tiantian Xu*, Magnetically-driven biohybrid blood hydrogel fibres for personalized intracranial tumour therapy under fluoroscopic tracking.Nature Biomedical Engineering2025, DOI: 10.1038/s41551-025-01382-z.
论文链接:https://www.nature.com/articles/s41551-025-01382-z





