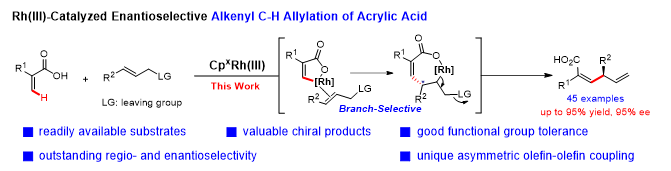
化学与环境工程学院王守国教授团队在Journal of the American Chemical Society国际期刊上发表题为“Direct Catalytic Enantioselective C(sp2)–H Allylation of Acrylic Acids: Modular Access to Chiral 1,4-Skipped Dienes”的研究论文,阐述了一例手性CpxRhIII催化的丙烯酸直接不对称烯基C(sp2)–H烯丙基化反应,实现了丙烯酸与烯丙醇酯之间的高效、不对称交叉偶联,为手性1,4-跳烯二烯结构的模块化合成提供了一条全新的策略。

手性分子的高效构建是有机合成与不对称催化领域的核心问题之一。其中,直接利用惰性的C–H键作为反应位点,不仅能够显著提高原子与步骤经济性,也为复杂手性骨架的快速构建提供了理想路径。然而,游离羧酸在过渡金属催化的不对称C–H官能化中往往面临配位弱、反应选择性难以精确控制等挑战,使该方向长期处于“概念可行但方法稀缺”的状态。
手性1,4-跳跃二烯的模块化合成途径
针对上述挑战,作者发展了一种手性CpxRhIII催化体系,结合羧酸“原位导向基团”策略,首次实现了丙烯酸烯基C(sp2)–H键的直接不对称烯丙基化反应。该反应以丙烯酸衍生物和烯丙醇醋酸酯为偶联伙伴,在温和条件下高效进行,选择性构建支链型手性1,4-跳烯二烯羧酸产物。在最优条件下,反应可在室温下获得超过90%的收率和最高95% ee的优异对映选择性,且表现出完全的支链选择性。该体系对多种α-芳基和α-烷基取代丙烯酸及结构多样的烯丙醇酯均具有良好兼容性,体现出优异的官能团耐受性。机理研究表明,反应经由“迁移插入–β-乙酸根消除”路径进行,对映选择性在迁移插入步骤中由手性CpxRhIII催化剂的空间位阻效应所确立。该工作拓展了羧酸导向不对称C–H键官能化的反应模式,并为手性1,4-跳烯二烯这一重要结构单元的高效构建提供了原子经济、步骤简洁的新途径。该策略有望进一步推广至其他羧酸体系,并在不对称合成与药物分子构建中展现更广阔的应用前景。本文第一作者为深圳大学副研究员罗木鹏博士,其主要贡献包括反应体系的构建、底物拓展及机理研究等。王守国教授为独立通讯作者,深圳大学为第一单位。
原文链接:https://doi.org/10.1021/jacs.5c17825





